一、乳腺癌基因检测的现状
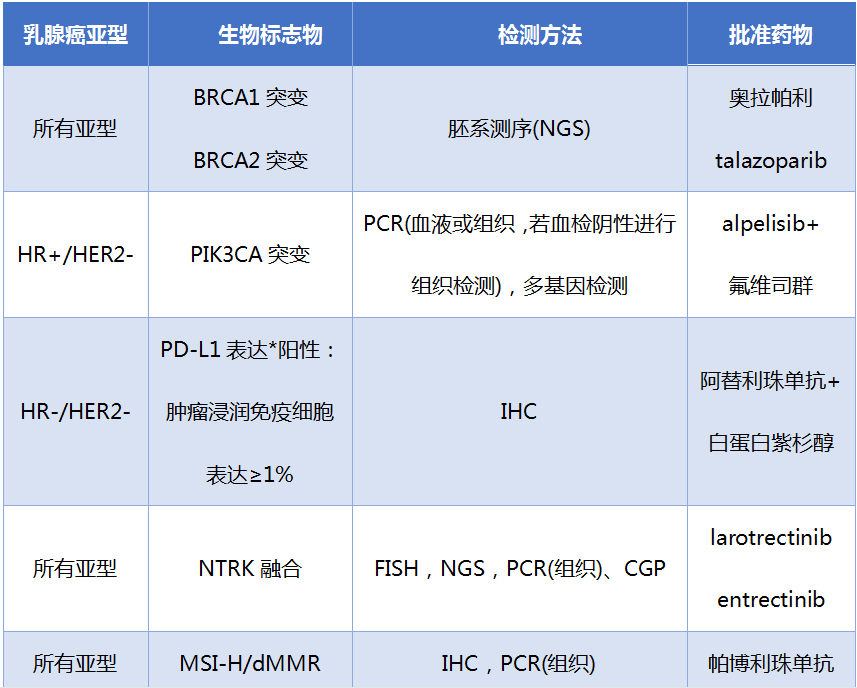
目前,对于乳腺癌的治疗,获批的靶向药物主要是基于单个生物标志物检测,表1中列举了除HER2过表达的靶向药物外的新的作用靶点或免疫治疗药物,这些药物的使用延长了乳腺癌患者的生存时间,给患者们带来了希望。目前临床常见的单基因检测方法,包括IHC、FISH和PCR,临床上主要用这些方法来检测ERBB2,还有很多药物靶点基因或耐药基因并未常规检测。随着越来越多的靶向治疗和免疫治疗药物的获批,需要更为精准和便捷的检测方法,让乳腺癌患者一次性能检测到更全的靶向基因和耐药基因,使医生对患者的基因突变情况有比较全面的认识,从而让患者有更多、更好的治疗选择。
表1 基于靶点检测获美国FDA批准的乳腺癌药物
二、全面基因组测序方法
全面基因组(comprehensive genomic profiling,CGP)测序通过利用二代测序技术一次可检测超300个基因,包括各种变异类型以及癌症相关的内含子区,另外,经过验证的CGP检测,比如FoundationOneCDx(F1CDx)还可以提供肿瘤突变负荷(TMB)和MSI等信息,TMB是一个泛肿瘤的生物标志物,今年FDA也批准了帕博利珠单抗用于治疗高TMB(TMB-H, ≥10 Mut/Mb)的实体瘤患者,为探寻分子治疗靶点和预测免疫治疗疗效提供了重要信息[3]。
传统的单基因检测方法和热点NGS检测一次只能筛查出有限数量的基因变异,会遗漏某些类型的基因变异,不能检测未知的分子变异和TMB/MSI,并且存在多次检测可能耗竭标本的问题。而CGP可以识别基因缺失和基因扩增,检测多种易位和融合。此外,CGP的灵敏度高,可一次检测更多的基因位点,避免患者不必要的额外检测和不必要的再次活检。CGP测序结果经过专业人士的分析,可提示患者可接受的靶向治疗,以及可能存在的耐药情况,减少不适用的药物的使用,提高生活质量;同时可优化已获批分子靶向药物和免疫靶向药物的使用;对于新型临床研究设计,通过CGP测序的筛选,可增加临床研究的入组[4-6]。
同时,CGP与全基因组测序(WGS)等覆盖位点更多的检测手段相比,后者需较长的检测时间、费用较高,CGP覆盖的是具有临床价值的基因,检测时间相对较短、费用相对较低,数据分析更具有临床价值。
精准检测是精准治疗的基石,随着精准医学研究的不断深入,CGP的使用会给患者带来更多获益,不论是靶向治疗还是免疫治疗的精准治疗,都能提供个体化治疗方案,CGP无疑是未来指导临床用药的有效手段之一。
三、全面基因组测序在乳腺癌诊疗中的运用
乳腺癌潜在靶向基因变异的情况较为繁杂,不同亚型潜在基因变异范围广泛,且不同病程的乳腺癌患者具有不同的基因变异情况。与早期乳腺癌相比,转移性乳腺癌突变负荷和克隆多样性增加。且转移性乳腺癌的基因组景观在临床相关基因组变化中具有丰富性,比早期乳腺癌更为复杂。识别与治疗及预后相关的基因组改变,将允许更早和更好地选择治疗方案[7]。通过CGP测序可以指导临床用药,探寻潜在的驱动基因,寻找罕见的突变靶点,探索耐药机制,预估患者能否从治疗中获益,阐明分子机制,有助于药物研发和新适应症的拓展,为乳腺癌个体化治疗提供了可能性。
美国FDA批准的第一个广泛伴随诊断(CDx) F1CDx共覆盖324个癌症相关基因以及TMB和MSI,基于CGP测序,可为临床靶向治疗提供依据和建议。有研究者采用F1CDx CGP对8,654例乳腺癌进行基因表达谱分析,结果显示,CGP可提示靶向的与临床相关的基因组变化,可通过预测对多种疗法的敏感性来对肿瘤进行分层,而IHC、PCR或热点检测无法识别许多临床相关的基因组改变。F1CDx可根据每位患者癌症的基因改变情况,为患者考虑适当的治疗方法并发现有可能存在的抗药性问题,是指导所有乳腺癌亚型治疗的强大工具[3]。
在TNBC患者中,通过CGP测序,可以了解到患者的TMB与MSI情况,评估患者后续免疫治疗的可能。此外,对于TNBC或者有家族史,发病年龄早的患者来说,BRCA的检测也尤为重要。在HR+的患者中,内分泌治疗的使用非常常见,PIK3CA、ESR1、NF1等内分泌耐药相关基因的检测也非常重要。此外,HR+患者有较多的靶点及相关临床研究的选择,比如PI3K抑制剂、mTOR抑制剂、CDK4/6抑制剂等,使用CGP测序,一次性检测相关的基因改变,有利于患者获益。对于HER2+患者,也可以选择检测ERBB2的突变,或者PIK3CA等相关基因来寻找下一步治疗的机会。其他的罕见的可靶向的突变如BRAF、NTRK的检测也可以为乳腺癌患者带来希望。更早更全面的了解患者的基因突变情况,有利于对患者治疗情况的预判,可以更早的使用患者可以获益的靶药,避免使用不适合患者的药物。
使用CGP可以进行大规模的临床样本的回顾性分析,构建真实世界临床基因数据库。曾有研究纳入某健康数据库中诊断为非小细胞肺癌(NSCLC),且进行了CGP检测的患者,利用CGP数据构建和验证了一个真实世界的电子病历记录。结果显示,在仅接受EGFR、ALK、ROS1单个基因检测的患者中,再行CGP发现高达30%的患者为假阴性。CGP的准确性得到了后续临床疗效的支持:如5例ALK检测阴性的患者,经CGP检测到ALK阳性结果后,接受ALK抑制剂治疗后,都至少获得了部分缓解(PR)。这项研究将CGP数据与临床信息结合,将基因特征与临床特征进行优效的关联,建立了一种大型、研究级的、纵向的临床基因数据库。该方法为了解癌症基因组学和发展精准医学提供了强大的工具[8]。然而在乳腺癌领域,该方面的研究较少,这也是我们后面可以探索的方向之一。
此外,随着数据复杂性和规模的不断增长,人们期望利用深度学习(deep learning)和人工智能来分析集成的“基因组学”数据,基于CGP建立的基因数据库将有助于癌症的大数据分析,进一步推动癌症精准诊疗的发展[9]。
四、全面基因组测序检测所面临的挑战
需要专业的生物信息团队:CGP高质量分析需要生物信息学专业知识的分析和计算,识别基因改变并确定其临床意义,通常需要复杂的算法构建和持续的系统性能统计分析,包括测序覆盖范围的深度和一致性。生物信息学团队需要进行多次调试,以使系统在灵敏度和特异性方面达到最佳性能。缺乏训练有素生物信息学家是许多实验室的发展临床CGP测试服务的主要障碍。随着检测样本的不断增多,肿瘤大数据库的建立,需要更为熟练的人员解读数据与疗效相关性分析。
MTB模式的缺乏:基于CGP测序得到的大量基因数据,如何转化为临床获益,这也是CGP测序临床应用上的痛点。因此,肿瘤大数据时代的“MDT 2.0”——MTB(分子肿瘤专家委员会)应运而生。ESMO对于MTB的定义为:一种多学科的协作模式,主要是从分子层面讨论肿瘤精准治疗的问题;临床医生(主要是肿瘤学家)和病理学家是MTB的核心成员,遗传学家、医学生物学家和生物信息学家是重要成员。
MTB在欧美国家目前已大力开展。根据美国AUBMC(贝鲁特美国大学医学中心)的数据,87.2%的肿瘤患者在MTB项目中确定诊断方案,87.8%肿瘤患者通过MTB获得治疗计划方案。此外,中国指南共识同样强调要重视MTB的应用。然而MTB模式目前在中国的使用并不多,因此将来推进MTB模式的开展也尤为重要。
五、展望
乳腺癌的分子机制非常复杂,因此寻找治疗靶点及分析预后因素,让患者获益具有很大的临床需求。尽管目前CGP在中国临床实践过程中的应用还不是特别普遍,但是有很大的临床价值。未来CGP可从以下方面进行研究:目前靶向治疗的优化,明确靶向耐药机制,开发新一代的抑制剂克服耐药;治疗靶点的拓展,探寻新的更多的治疗靶点,让更多的患者有机会接受靶向治疗;罕见突变位点的识别;免疫单药以及联合用药的合理应用,发掘免疫治疗的真正优势人群。以上治疗的优化都离不开基因检测。同时,使用CGP可以进行大规模的临床样本的回顾性分析,构建真实世界临床基因数据库,对乳腺癌患者的临床特征和基因特征进行优效的关联,建立大型基因数据库。
